Metodica n° 10: “SOS ambiente: la natura risponde”
Biotecnologie Agrarie per l’ambiente: utilizzo di piante transgeniche (Arabidopsis thaliana) in grado di mettere in evidenza la presenza di metalli pesanti (cadmio) nel suolo.
Richiami teorici
Prerequisiti:
Struttura DNA e RNA; duplicazione del DNA; promotore ed espressione genica; vettori di clonaggio; separazione elettroforetica di acidi nucleici su gel di agarosio; azione della trascrittasi inversa; Reazione a Catena della Polimerasi (PCR); ruolo delle piante nella catena alimentare.PCR:
Si tratta di una tecnica che consiste nell’amplificazione specifica di tratti di DNA mediante reazioni a catena della DNA polimerasi. Il principio è molto semplice. Data una sequenza di DNA a doppio filamento e due corte sequenze oligonucleotidiche (primer), complementari ad un tratto di filamento alle due estremità del DNA da amplificare, in presenza di una DNA polimerasi termostabile (Taq polimerasi) e di una miscela di desossinucleotidi trifosfati in appropriate condizioni di reazione, è possibile far copiare numerosissime volte il tratto compreso tra i due primer, semplicemente facendo variare ciclicamente la temperatura di reazione. Il processo è automatizzato e molto rapido. Esso consta dei seguenti passaggi:- denaturazione a T di circa 95°C: la doppia elica si apre rendendo disponibile lo stampo per la sintesi delle catene complementari.
- Annealing o ibridazione: la temperatura si abbassa e, in virtù delle loro minori dimensioni e della loro concentrazione, i primer si legano al DNA stampo prima che si rinaturi.
- sintesi di DNA a T di circa 72°C: inizia la sintesi a partire dai primer procedendo lungo i filamenti singoli; viene sfruttata l’azione della DNA polimerasi termostabile (Taq polimerasi).
Nella RT-PCR l’amplificazione è preceduta da una retrotrascrizione, in cui l’enzima trascrittasi inversa sintetizza molecole di cDNA a partire da RNA. Si ottiene così un ibrido RNA-DNA, da cui si rimuove l’RNA mediante una RNasi. Quindi si procede con una PCR normale.

Elettroforesi:
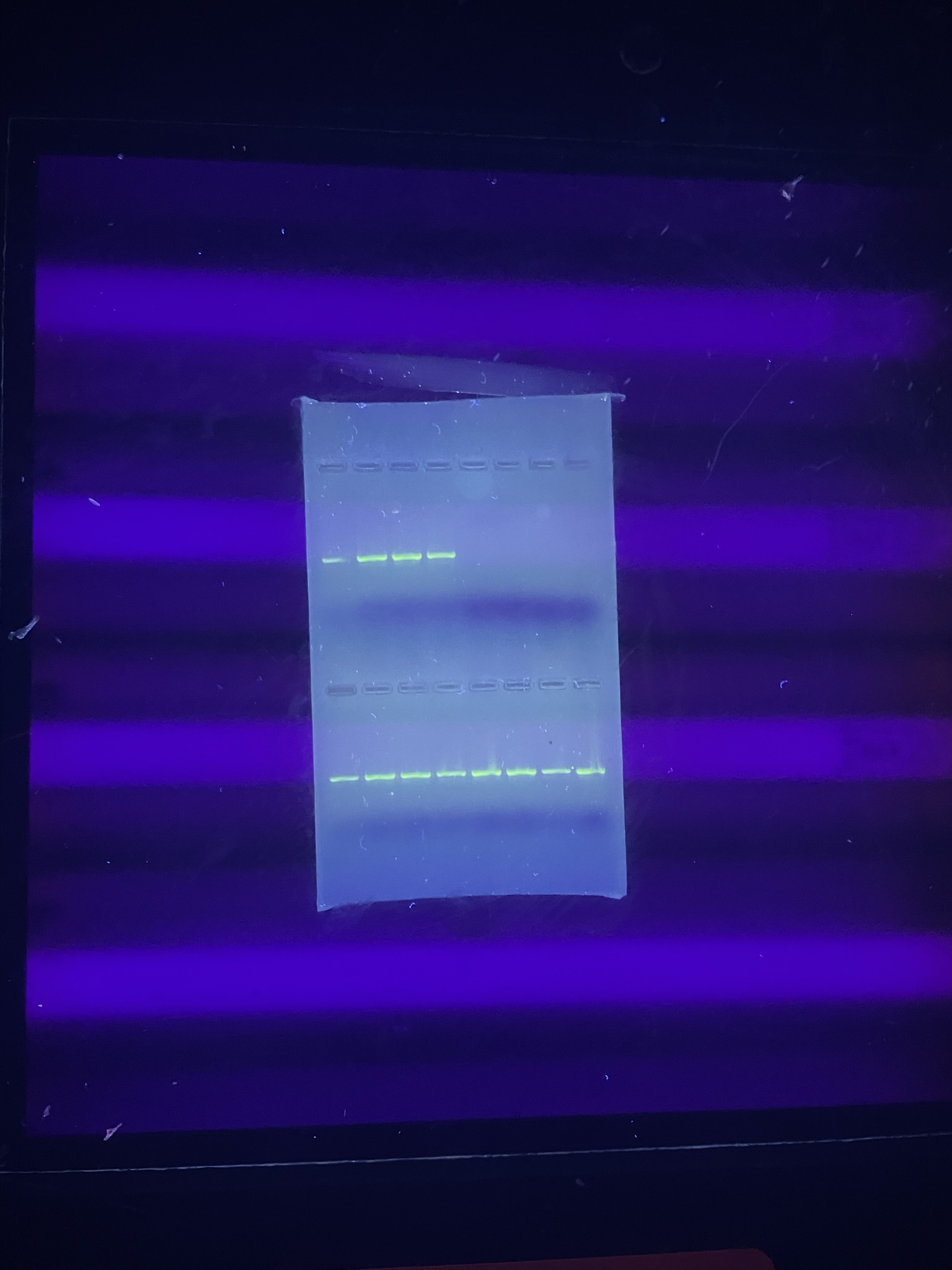
È una tecnica che consente di separare in base alle loro dimensioni (peso molecolare) molecole dotate di carica, facendole migrare su un gel in presenza di un campo elettrico. Il gel è costituito da agarosio e può essere immaginato come una rete tridimensionale attraverso le cui maglie migrano le molecole sotto l’azione di un campo elettrico. Le molecole di DNA sono cariche negativamente per la presenza di gruppi fosfato e migrano dal polo negativo verso il polo positivo.Per un certo intervallo di pesi molecolari, la velocità di migrazione è in funzione del peso molecolare: tanto più grande è la molecola, tanto minore è la velocità di migrazione. E viceversa: tanto più piccola è la molecola di DNA, tanto più velocemente migra. Le molecole di DNA di diversa lunghezza vengono pertanto separate in base alla diversa velocità di migrazione.
Per poter determinare la lunghezza delle molecole di DNA in esame, precedentemente separate mediante elettroforesi, viene “caricato” sul gel anche il cosiddetto marcatore di peso molecolare, ossia una miscela di frammenti di DNA di cui è noto il peso molecolare. Confrontando la posizione dei frammenti a peso molecolare noto con quella dei frammenti di DNA in esame, è possibile calcolare il peso molecolare di questi ultimi, ossia la loro lunghezza.
Al termine i vari frammenti di DNA, essendo incolori, possono essere visualizzati, immergendo il gel in un colorante. Il DNA delle diverse classi di peso molecolare è visibile sotto forma di bande distinte: sono le cosiddette bande di DNA .
In genere in laboratorio le bande si visualizzano esponendo il gel alla luce ultravioletta. Questo è dovuto al fatto che, durante la preparazione del gel, all’agarosio è stato aggiunto il bromuro di etidio, una sostanza che ha la proprietà di legarsi al DNA e di emettere fluorescenza se esposta a luce UV.

- I bioindicatori:Questi ultimi sono organismi o comunità di organismi che forniscono informazioni sulla qualità ambientale e sui livelli di inquinamento, perché rispondono a determinate condizioni ambientali con variazioni che possono essere identificate e talvolta quantificate.
L’utilizzo delle piante transgeniche come bioindicatori presenta alcuni vantaggi, legati principalmente alla loro natura di organismi complessi, sedentari, naturalmente adatti alla crescita su suolo, il cui allevamento è relativamente facile e poco costoso. Inoltre, le piante rappresentano il principale punto di ingresso nella catena alimentare umana e animale per numerosi inquinanti e/o composti tossici.
I bioindicatori vegetali transgenici sono stati ottenuti utilizzando un approccio di ingegneria genetica che ha permesso di inserire in alcune specie uno o più geni, la cui espressione produce un segnale biochimico facilmente identificabile e misurabile (ad esempio attraverso la colorazione di un substrato) ed è subordinata alla presenza di un particolare contaminante.
I metalli pesanti sono inquinanti del suolo che possono essere assorbiti nei tessuti dei vegetali e dare luogo a evidenti fenomeni di bioaccumulo nella pianta e di biomagnificazione nel passaggio a livelli trofici successivi della catena alimentare. Il cadmio è un metallo pesante pericoloso sia dal punto di vista della contaminazione ambientale, che della biopersistenza (rimane decine di anni nell’organismo umano), che delle proprietà tossicologiche (ad esempio con danni al processo di filtrazione renale).
Per la determinazione del cadmio nel suolo si utilizza una pianta geneticamente modificata: Arabidopsis thaliana, una comune pianta della famiglia del cavolo. Attraverso un opportuno vettore (agrobacterium tumefaciens) il genoma della pianta è stato modificato attraverso l’inserimento di un “gene reporter” che è in grado di consentire la valutazione diretta di un determinato parametro ambientale, in questo caso la presenza di cadmio.
Il gene reporter utilizzato è chiamato GUS (b-glucoronidasi) da Escherichia Coli, il cui prodotto è in grado di colorare in blu le cellule vegetali cresciute in presenza di Cadmio, con l’aggiunta del substrato adatto.
Metodica di laboratorio
- Scopo dell’esperienza: Valutazione, attraverso piante di Arabidopsis thaliana geneticamente modificate, della presenza di cadmio nel suolo attraverso saggio istochimico e attraverso analisi di espressione del gene GUS.
Procedimento: Il procedimento in dettaglio sarà fornito in laboratorio CUS-MI-BIO.
Materiale occorrente: Indicazioni specifiche saranno fornite in laboratorio CUS-MI-BIO.
Saggio istochimico
È condotto su plantule cresciute precedentemente in laboratorio, in terreno ricco di cadmio. In presenza del substrato adatto X-Gluc (acido – 5 – bromo – 4 –cloro – 3 – indolil – b – D-glucoronico), il prodotto del gene GUS (la b –glucoronidasi), espresso solo in presenza di Cadmio, scinde la molecola in un precipitato insolubile e colorato di indaco facilmente osservabile dopo decolorazione dei tessuti con etanolo 96% v/v.
L’incubazione delle piante a 37°C per una notte al buio in presenza di X-Gluc è effettuata dai tecnici del CUS-MI-BIO.

Analisi di espressione del gene GUS
-
- Estrazione dell’RNA dalla macerazione di plantule cresciute precedentemente in terreno ricco di cadmio ed in terreno di controllo senza cadmio.
- Retrotrascrizione a cDNA degli RNA estratti e amplificazione con PCR dei geni codificanti e di un gene di controllo (per verificare che la tecnica applicata abbia funzionato) a partire dai loro mRNA.
- Separazione elettroforetica in gel di agarosio dei prodotti di PCR e osservazione con luce UV.
Osservazioni:
Risultati attesi:

Saggio istochimico

Analisi genetica
- Valutazione dei rischi: (seguite le indicazioni dei tecnici del CUS-MI-BIO):
- In laboratorio indossare sempre il camice (portate ccamice ed occhiali vostri). Al termine delle attività, prima di lasciare il laboratorio, togliersi il camice. In ogni caso, non uscire dal laboratorio per recarsi in altre aree senza aver prima tolto il camice.
- Non introdurre in laboratorio borse, zaini o altro materiale non necessario.
- Se sono lunghi, legare i capelli.
- Seguire scrupolosamente le indicazioni riportate nei protocolli di esperimento.
Utilizzazione del forno a microonde:
- Non accendere il forno se è vuoto.
- Non utilizzare il forno con materiali infiammabili.
- Non utilizzare il forno con recipienti sigillati: svitare i tappi delle bottiglie, rimuovere i coperchi.
- Non utilizzare il forno con oggetti metallici o metallizzati e con carta d’argento.
- Non riempire eccessivamente i recipienti: il liquido, bollendo, potrebbe traboccare.
- Proporzionare la potenza e il tempo di riscaldamento al contenuto in acqua di quanto viene riscaldato. In particolare, nel caso di soluzioni acquose, il liquido potrebbe surriscaldarsi oltre il punto di ebollizione, senza che appaiano bollicine. Ciò può portare al traboccamento improvviso di liquido bollente. Per prevenire questo pericolo, mescolare il liquido prima di scaldarlo e lasciarlo riposare per qualche minuto prima di togliere il recipiente dal forno.
- In caso di incendio del contenuto del forno, tenere chiusa la porta, spegnere il forno, staccare la spina dalla presa di corrente lasciando che il fuoco si estingua per soffocamento.
Utilizzazione dell’apparecchiatura per elettroforesi:
- Assicurarsi che l’alimentatore sia spento, prima di collegare i morsetti.
- Assicurarsi che il coperchio della vaschetta sia correttamente posizionato, prima di collegare i morsetti.
- Prima di rimuovere il coperchio della cella elettroforetica, spegnere l’alimentatore e staccare i morsetti.
Utilizzazione della centrifuga:
- Chiudere accuratamente il tappo delle provette, per evitare la fuoriuscita di liquido e la formazione di aerosol.
- Assicurarsi che il rotore sia bilanciato: provette di ugual peso devono essere inserite negli alloggiamenti diametralmente opposti.
- Chiudere il coperchio della centrifuga prima di avviarla.
-
Non cercare di aprire il coperchio prima del completo arresto del rotore. In caso di fuoriuscita dei liquidi dalle provette, avvertire il personale docente.
Smaltimento dei rifiuti:
-
Tutto il materiale monouso (puntali, provette, pipette, ecc.) va messo in appositi contenitori per rifiuti.
Manipolazione dell’etidio bromuro (sostanza mutagena):
- Usare i guanti “disposable”;
- evitare di spargere il prodotto sul banco di lavoro;
-
terminata l’utilizzazione del prodotto o delle sue soluzioni, provvedere allo smaltimento tenendo presente che le soluzioni di etidio bromuro vanno raccolte nell’apposito contenitore.
Manipolazione del fenolo:
- Lavorare sotto cappa chimica;
- usare i guanti “disposable”;
- evitare di spargere il prodotto sul banco di lavoro.